近日,動物科技學院(動物醫學院)師科榮課題組在Cell & Bioscience在線發表了題為“Menin orchestrates hepatic glucose and fatty acid uptake via deploying the cellular translocation of SIRT1 and PPARγ”的研究論文。在讀博士生劉廷俊和已畢業碩士李冉冉為該論文的第一作者,師科榮副教授為論文的通訊作者。
非酒精性脂肪肝(NAFLD)居于肝病之首,在全球成年人中有近1/4的發病率。NAFLD是一種以非酒精因素導致的肝細胞內脂肪過度沉積為主要特征的臨床病理綜合征,往往與營養過剩所致的體重增長過快、肥胖、糖尿病、高脂血癥等引起的胰島素抵抗和遺傳易感性密切相關,是一種獲得性代謝應激性肝損傷。肝細胞的代謝穩態對于肝臟乃至整個機體的代謝平衡舉足輕重。
Menin是由Men1基因編碼的支架蛋白,以“抑癌基因”的角色募集豐富的轉錄因子(互作)參與基因的表觀遺傳修飾,通過激活或抑制基因的表達而廣泛調控細胞的生命活動。Menin的功能突變或缺失導致多發性內分泌腺瘤病Ⅰ型(MEN1),對于機體的代謝具有重要的調控功能。例如,肝組織特異性Menin缺失或肝細胞特異性Menin缺失都易發(非酒精性)脂肪肝,同時伴隨胰島素抵抗和Ⅱ型糖尿病表型。這表明Menin與肝臟代謝穩態之間的潛在聯系。該研究發現Menin可以調控肝細胞的代謝穩態,“運籌帷幄”肝臟糖代謝與脂代謝之間的局勢,扮演“謀局者”的角色。肝細胞Menin既可以通過與細胞能量傳感器SIRT1、PPARγ相互作用來靶向脂質轉運蛋白Fabp3/4/5以及Cd36的表達,從而調控脂質的吸收與代謝;又可以與FoxO1相互作用來靶向Gk、Pck的表達,從而調控葡萄糖的吸收與代謝。不僅如此,Menin還可以募集和部署這些互作蛋白在胞質/胞核中的分布,通過協調肝細胞對葡萄糖和脂肪酸的攝取進而調控細胞的代謝穩態。
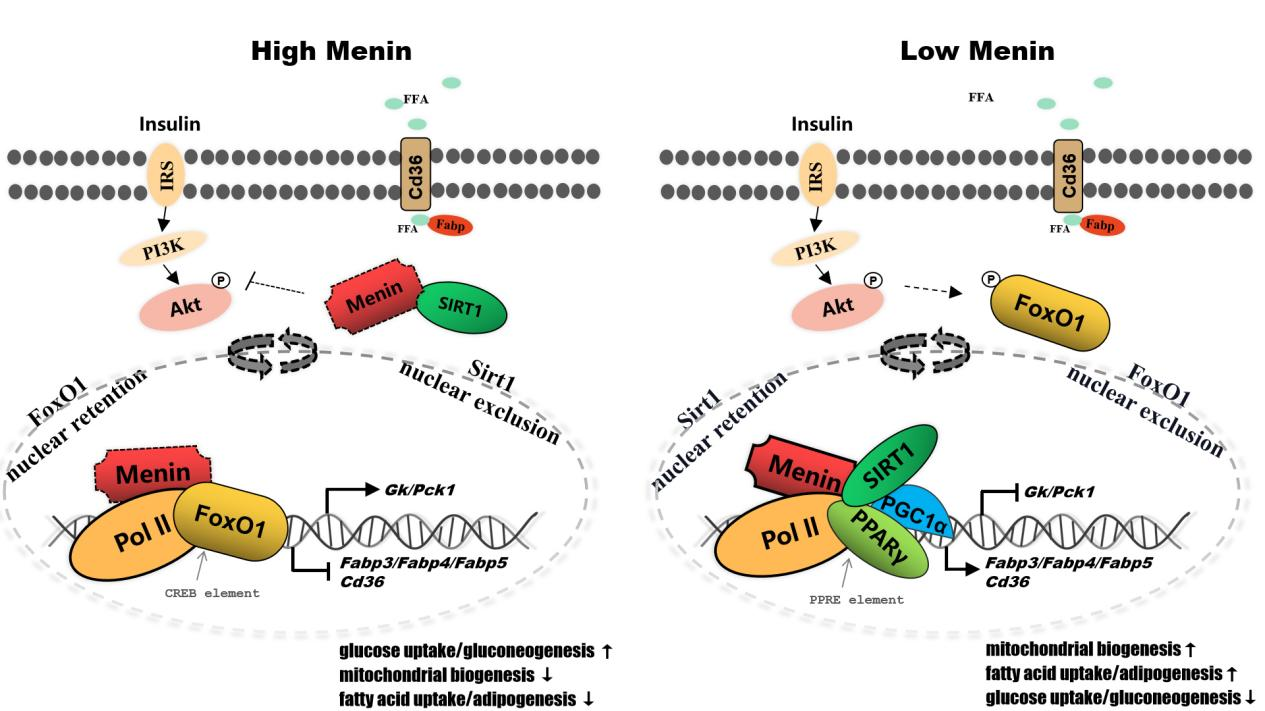
該研究是該課題組繼解析了Menin介導乳腺代謝機制之后的新作。近年Menin因其廣泛參與細胞的代謝調節活動而作為人類多種疾病的藥物研發靶標。在肝臟中,Menin的表達失調是導致肝細胞糖脂代謝紊亂、形成脂肪沉積的重要因素。Menin部署肝細胞中FoxO1/PPARγ/SIRT1上的作用模型,也與美國糖尿病協會提出的最新建議不謀而合——用PPARγ激動劑(吡格列酮)和胰高血糖素樣肽-1(GLP1)受體激動劑治療糖尿病、NAFLD或NASH(非酒精性脂肪性肝炎)。該研究論文為我們理解脂肪肝的發病機制提供新的認識,同時,為靶向Menin治療脂肪肝(NAFLD、MAFLD)及其它肝病(NASH)提供了理論支撐。
課題組自2013年開始聚焦于奶牛圍產期脂肪肝的發生與預防,該論文是脂肪肝發生分子機制的又一突破。同時,課題組研發的系列無創新型標志物可用于脂肪肝發生奶牛的診斷與提前預警/預防,獲得3項授權國際發明專利和4項授權國家發明專利、申請發明專利3項(包括1項美國發明專利)。研究先后得到了國家自然科學基金、國家重點研發計劃課題、山東省農業良種工程項目和山東省自然科學基金的資助。
編 輯:萬 千
審 核:賈 波




