近日,生命科學(xué)學(xué)院孟慶偉/莊焜揚(yáng)團(tuán)隊(duì)在《Plant Biotechnology Journal》在線發(fā)表了題為“Differential heat-response characteristics of two plastid isoforms of triose phosphate isomerase in tomato”的研究論文。陳崇博士、張萌博士為該論文的第一作者,莊焜揚(yáng)副教授為該論文的通訊作者。
葉綠體磷酸丙糖異構(gòu)酶(TPI)是碳同化過程中的關(guān)鍵酶,其在高溫脅迫下的穩(wěn)定對于光合作用的維持十分重要。番茄中存在兩個TPI同源蛋白:SlTPI1和SlTPI2,兩者在正常生長條件下功能冗余:tpi1 tpi2雙突株系中光合蛋白損失嚴(yán)重,而tpi1或tpi2單突變體不具有明顯表型。但在高溫脅迫下,與SlTPI1相比,SlTPI2具有更好的熱穩(wěn)定性。
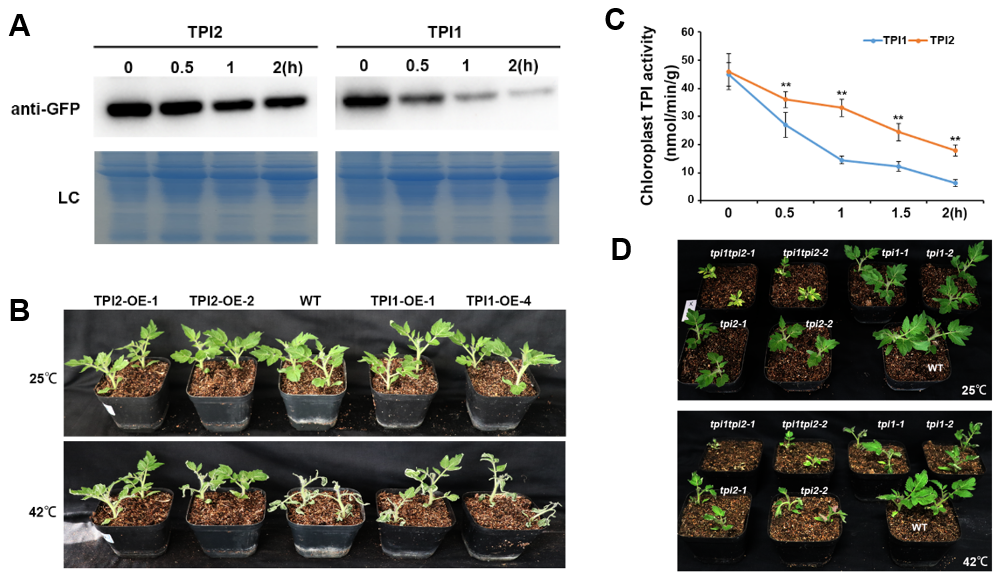
圖1. SlTPI1及SlTPI2的耐熱性分析
高溫脅迫下SlWRKY21、SlHSF2A及SlHSF7A被誘導(dǎo)上調(diào)表達(dá)。其中 SlWRKY21抑制耐熱能力差的SlTPI1的表達(dá)。而SlHSF2A及SlHSF7A激活了耐熱能力強(qiáng)的SlTPI2表達(dá),增強(qiáng)了高溫脅迫下的光合能力。
該研究解析了番茄磷酸丙糖異構(gòu)酶的耐熱機(jī)制,對維持作物高溫脅迫下的光合能力提供了潛在的提升策略。
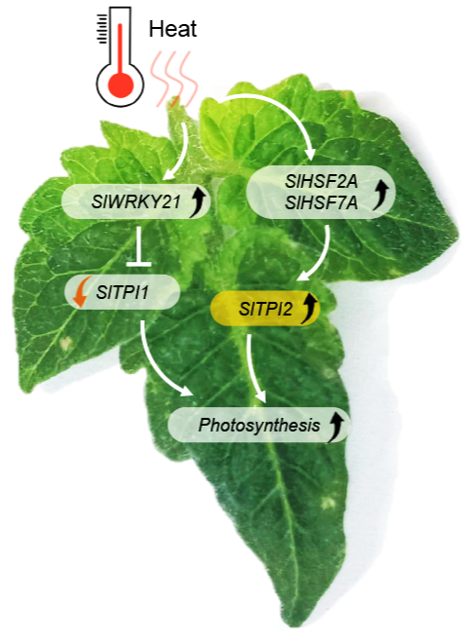
圖2. SlTPI1及SlTPI2在高溫脅迫下的作用模式圖
該研究得到了國家重點(diǎn)研發(fā)計劃、國家自然科學(xué)青年基金、山東省自然科學(xué)青年基金的資助。
論文鏈接:https://doi.org/10.1111/pbi.14212
編 輯:萬 千
審 核:賈 波




